Resumen para médicos sobre medicamentos antivirales contra la influenza
La información en esta página debe considerarse como actual para las prácticas clínicas de la temporada de influenza 2023-2024 en relación con el uso de medicamentos antivirales contra la influenza. Los médicos también pueden desear consultar las recomendaciones de la IDSA para la quimioprofilaxis antiviral y el tratamiento antiviraly las Directrices de ATS-IDSA CAP para adultos.
Grupos de prioridad para el tratamiento con antivirales para la influenza
Se recomienda el tratamiento con antivirales lo antes posible para todos los pacientes con influenza presunta o confirmada que:
- están hospitalizados;
- padecen una enfermedad progresiva grave o con complicaciones, o
- corren mayor riesgo de tener complicaciones por la influenza.
No se debe esperar la confirmación de las pruebas de laboratorio de infección por el virus de la influenza para tomar la decisión de iniciar el tratamiento con antivirales en pacientes con influenza presunta. Para los grupos de prioridad especificados más arriba, se debe iniciar el tratamiento antiviral empírico lo antes posible.
Los profesionales médicos pueden considerar el tratamiento antiviral empírico temprano de pacientes ambulatorios que no son de alto riesgo con influenza presunta con base en su criterio clínico, si el tratamiento puede iniciarse dentro de las 48 horas de la aparición de los síntomas.
Opciones de medicamentos antivirales
- Para pacientes hospitalizados con influenza presunta o confirmada, se recomienda la iniciación del tratamiento antiviral con oseltamivir administrado por vía oral o enteral lo antes posible.
- Para los pacientes con complicaciones o enfermedades progresivas e influenza presunta o confirmada (como neumonía o la exacerbación de afecciones crónicas subyacentes) se recomienda iniciar el tratamiento antiviral con oseltamivir oral lo antes posible.
- En el caso de los pacientes con influenza presunta o confirmada sin complicaciones, se puede usar oseltamivir de administración oral, zanamivir con inhalador, peramivir intravenoso o baloxavir oral para el tratamiento, en función de los grupos de edad aprobados y las contraindicaciones. En un ensayo controlado aleatoriamente, el baloxavir demostró mayor eficacia que el oseltamivir en adolescentes y adultos con infección por el virus de la influenza B (Ison, 2020).
Circulación simultánea de los virus de la influenza y SARS-CoV-2
En los períodos de circulación simultánea de los virus de la influenza y SARS-CoV-2, se recomienda iniciar el tratamiento antiviral empírico de la influenza lo antes posible para los siguientes grupos de prioridad: a) pacientes hospitalizados con enfermedades respiratorias, b) pacientes ambulatorios con enfermedades respiratorias graves, complicadas o progresivas, y c) pacientes ambulatorios con mayor riesgo de presentar complicaciones a causa de la influenza que presenten síntomas de enfermedad respiratoria aguda (con o sin fiebre).
- La influenza y el COVID-19 tienen signos y síntomas que se superponen. Las pruebas de detección pueden ayudar a distinguir la infección por el virus de la influenza de la infección por el SARS-CoV-2. Sin embargo, no se recomienda que los profesionales médicos esperen los resultados de las pruebas de detección de influenza (Tabla 3), de las pruebas de detección del SARS-CoV-2 ni de los ensayos moleculares multiplex que detectan los virus de la influenza A y B y el SARS-CoV-2 (Tabla 4) para iniciar el tratamiento antiviral empírico para la influenza en los grupos de prioridad mencionados arriba.
- Es posible la infección simultánea con los virus de la influenza A y B y el SARS-CoV-2 y es un escenario que se debe considerar, especialmente en pacientes hospitalizados con enfermedad respiratoria grave.
- Los profesionales médicos deben saber que una prueba de detección de SARS-CoV-2 con resultado positivo no descarta una infección por el virus de la influenza. En el caso de los pacientes hospitalizados con influenza presunta que iniciaron tratamiento antiviral empírico con oseltamivir, el uso de ensayos moleculares para la detección de la influenza (Tabla 3) o los ensayos multiplex que permiten detectar los virus de la influenza y el SARS-CoV-2 (Tabla 4) pueden aportar información para el manejo clínico.
- Los profesionales médicos deben saber que un resultado positivo en la prueba de detección de la influenza no descarta una infección por SARS-CoV-2. Para los pacientes hospitalizados con un resultado positivo en la prueba de detección del virus de la influenza, se debe iniciar el tratamiento antiviral para la influenza con oseltamivir lo antes posible, y los profesionales médicos además deben seguir las directrices para el diagnóstico y el tratamiento de neumonía adquirida a nivel comunitario (guías de tratamiento de neumonía adquirida a nivel comunitario para adultos: Metlay, 2019) y otras infecciones respiratorias, incluida la infección por SARS-CoV-2 (directrices de tratamiento del COVID-19 de los NIH y directrices de tratamiento del COVID-19 de la IDSA) si tiene indicación clínica y mientras esperan los resultados de la prueba de detección del SARS-CoV-2. El oseltamivir no tiene actividad in vitro contra del SARS-CoV-2 (Choy, 2020).
- Los profesionales médicos pueden utilizar herramientas de telemedicina en lugar de consultas presenciales para los pacientes con enfermedad respiratoria aguda. Puede resultar útil que los proveedores dispongan líneas telefónicas de triaje para que los pacientes de alto riesgo puedan informar sus síntomas por teléfono. Consulte Algoritmo para ayudar en la evaluación de pacientes con posible diagnóstico de influenza mediante comunicación telefónica con el consultorio médico.
- Se debe indicar a los pacientes con mayor riesgo de presentar complicaciones a causa de la influenza que llamen a su proveedor de servicios médicos lo antes posible si tienen síntomas de enfermedad respiratoria aguda (con o sin fiebre) para evaluar la posibilidad de infección por los virus de la influenza A o B (y tratamiento antiviral temprano), SARS-CoV-2 y otros microbios patógenos respiratorios.
- Los profesionales médicos pueden considerar iniciar el tratamiento antiviral empírico temprano (≤48 horas después de la aparición de la enfermedad) de pacientes ambulatorios que no son de alto riesgo con influenza presunta con base en el criterio médico, incluso sin una consulta presencial. También se debe considerar la infección por SARS-CoV-2 y otras etiologías de enfermedades respiratorias agudas.
- Las directrices de tratamiento para el COVID-19 de los Institutos Nacionales de la Salud (NIH): influenza y COVID-19 están disponibles.
- Los algoritmos clínicos para la prueba y el tratamiento de la influenza cuando los virus del SARS-CoV-2 y de la influenza están circulando también están disponibles.
Los antivirales que combaten los virus de la influenza son un complemento importante de la vacuna contra la influenza en el control de la enfermedad.
- Los medicamentos antivirales contra la influenza recetados se pueden usar para tratar la influenza o para prevenirla.
- Seis medicamentos antivirales contra la influenza recetados están aprobados en los Estados Unidos.
- Se recomiendan cuatro medicamentos antivirales contra la influenza aprobados por la Administración de Alimentos y Medicamentos de EE. UU. (FDA) para ser utilizados en los Estados Unidos.
- Tres medicamentos son medicamentos antivirales químicamente relacionados, conocidos como inhibidores de la neuraminidasa, que inhiben la enzima neuraminidasa viral y actúan contra los virus de influenza A y B: fosfato de oseltamivir oral (disponible en versión genérica o con el nombre comercial Tamiflu®), zanamivir por inhalación (nombre comercial Relenza®) y peramivir intravenoso (nombre comercial Rapivab®).
- El cuarto medicamento es el baloxavir marboxil oral (nombre comercial Xofluza®), que actúa contra los virus de influenza A y B, pero tiene un mecanismo de acción diferente al de los inhibidores de la neuraminidasa. Baloxavir es un inhibidor de la endonucleasa dependiente de la cápsula que interfiere en la transcripción del ARN viral e impide la reproducción del virus.
- Hay más información disponible sobre los cuatro medicamentos antivirales recomendados: Tabla 1.
- Los otros dos medicamentos antivirales contra la influenza aprobados por la FDA (amantadina y rimantadina) no se recomiendan para el tratamiento o la quimioprofilaxis debido a los altos niveles de resistencia de los virus de influenza A en circulación.
- Las pruebas clínicas y los datos de observación muestran que el tratamiento antiviral temprano puede reducir la duración de la fiebre y los síntomas de la enfermedad, y reducir el riesgo de presentar complicaciones por la influenza (p. ej.: otitis media en niños pequeños, neumonía e insuficiencia respiratoria).
- En adultos hospitalizados con influenza, se notificó que el tratamiento temprano con oseltamivir reduce la duración de la hospitalización y muertes en hospitales en estudios de observación.
- En niños hospitalizados, se notificó que el tratamiento antiviral temprano con oseltamivir reduce la duración de la hospitalización en estudios de observación.
- El mayor beneficio clínico se obtiene cuando el tratamiento con antivirales se inicia en las 48 primeras horas de la aparición de la influenza.
Abreviaturas: N/A = no aplicable, EPOC = enfermedad pulmonar obstructiva crónica.
- El fosfato de oseltamivir oral ha sido aprobado por la FDA para el tratamiento de la influenza grave pero sin complicaciones dentro de los 2 días de la aparición de la enfermedad en personas de 14 días de vida en adelante y para la quimioprofilaxis en personas de 1 año de edad en adelante. Si bien el uso de oseltamivir oral para el tratamiento de la influenza en bebés con menos de 14 días de vida y para la quimioprofilaxis en bebés de 3 meses a 1 año no forma parte de las indicaciones aprobadas por la FDA, es recomendado por los CDC y la American Academy of Pediatrics. Si el niño tiene menos de 3 meses, no se recomienda el uso de oseltamivir para la quimioprofilaxis a menos que se considere que la situación es crítica debido a los datos limitados que existen para este grupo etario.
- Autolesión o delirio; reportados principalmente entre pacientes pediátricos japoneses.
- El zanamivir por inhalación está contraindicado en pacientes con enfermedades subyacentes de las vías respiratorias o enfermedad pulmonar obstructiva crónica, y en pacientes con antecedentes de alergia a la lactosa o la proteína de la leche.
- El peramivir intravenoso está aprobado por la FDA para el tratamiento de la influenza grave pero sin complicaciones dentro de los 2 días de la aparición de la enfermedad en personas de 6 meses o más. La efectividad del peramivir se determina de acuerdo con las pruebas clínicas en oposición al placebo en las que el tipo de virus predominante era el virus de la influenza A; en una prueba, se inscribió una cantidad limitada de personas infectadas con el virus de la influenza B.
- No hay datos disponibles sobre el uso de peramivir como tratamiento de quimioprofilaxis para la influenza.
- El baloxavir marboxil oral está aprobado por la FDA para el tratamiento de la influenza grave pero sin complicaciones dentro de los 2 días de la aparición de la enfermedad en personas de ≥5 años de edad que están sanas o en personas de ≥12 años que tienen alto riesgo de presentar complicaciones relacionadas con la influenza. La eficacia del baloxavir para la aprobación inicial de la FDA en octubre del 2018 se determinó según ensayos clínicos en pacientes ambulatorios de 12 a 64 años de edad que anteriormente estaban sanos (Hayden, 2018). El tratamiento con baloxavir de dosis única fue superior al de placebo y tuvo una eficacia clínica similar en el tiempo del alivio de los síntomas que un tratamiento de 5 días con oseltamivir.
En octubre del 2019, la FDA aprobó una indicación para el tratamiento con baloxavir de casos de influenza aguda pero sin complicaciones dentro de los 2 días de la aparición de la enfermedad en personas de 12 años de edad o más con alto riesgo de presentar complicaciones relacionadas con la influenza, con base en los resultados de un ensayo clínico (Ison, 2020). En este ensayo clínico de la iniciación temprana del tratamiento antiviral de la influenza sin complicaciones en pacientes con alto riesgo, el baloxavir fue superior al placebo y tuvo una eficacia similar al oseltamivir en cuanto al tiempo para el alivio de los síntomas. En el caso de los pacientes con infección por virus de influenza B, el baloxavir redujo considerablemente el tiempo promedio para mejorar los síntomas en comparación con el oseltamivir, por más de 24 horas.
En el caso de los pacientes con infección por virus de influenza B, el baloxavir redujo considerablemente el tiempo promedio para mejorar los síntomas en comparación con el oseltamivir, por más de 24 horas. No obstante, no hay datos disponibles sobre el tratamiento de la influenza con baloxavir en personas embarazadas, personas inmunodeprimidas o personas con influenza grave que no están hospitalizadas.
En agosto del 2022 la FDA amplió la aprobación del baloxavir para el tratamiento de influenza aguda sin complicaciones dentro de los 2 días de la aparición de los síntomas en niños de 5 años a <11 años sanos. Prospecto de XOFLUZA [963 KB, 22 páginas]. Esto se basó en los resultados clínicos secundarios de un ensayo clínico aleatorizado para comparar el baloxavir y el oseltamivir para el tratamiento de la influenza sin complicaciones en niños de 1 años a <12 años (Baker, 2021).
Un ensayo clínico aleatorizado notificó que la combinación de un inhibidor de la neuraminidasa (principalmente oseltamivir) y baloxavir para el tratamiento de pacientes hospitalizados con influenza de ≥12 años de edad no arrojó un beneficio clínico superior (periodo de mejora clínica) en comparación con el inhibidor de la neuraminidasa y el placebo (Kumar, 2022).
En noviembre del 2020, la FDA amplió la aprobación de baloxavir para incluir la profilaxis de la influenza para personas de ≥12 años de edad dentro de un lapso de 48 horas de contacto con una persona con influenza, con base en los resultados de un ensayo clínico entre los contactos cercanos del primer caso con influenza (Ikematsu, 2020). En este estudio, el baloxavir como profilaxis posterior a la exposición (PEP, por sus siglas en inglés) a la influenza en miembros del hogar (19 % eran menores de 12 años; 73 % recibieron baloxavir dentro de las 24 horas de la aparición de los síntomas del primer caso del hogar, que recibió tratamiento antiviral) redujo de manera sustancial el riesgo de influenza confirmada por laboratorio en un 86 % entre quienes recibieron baloxavir como PEP en relación con los que recibieron placebo (1,9 % [7 de 374] vs. 13,6 % [51 de 375]; relación de riesgo ajustado: 0.14; intervalo de confianza [IC] del 95 %, 0.06 a 0.3; P<0).
En agosto del 2022, la FDA amplió la aprobación del baloxavir para su uso en profilaxis posterior a la exposición en personas de 5 años de edad o más dentro de las 48 horas del contacto con una persona con influenza. Prospecto de XOFLUZA [963 KB, 22 páginas].
- Se recomienda que el tratamiento antiviral se realice cuanto antes en pacientes con contagio confirmado o posible de influenza que:
- están hospitalizados*,
- padecen una enfermedad progresiva grave o con complicaciones* o
- tienen un mayor riesgo de presentar complicaciones por la influenza.
*El oseltamivir administrado por vía oral o enteral es un antiviral recomendado para pacientes con enfermedad progresiva, grave o con complicaciones que no han sido hospitalizados y para pacientes hospitalizados a causa de la influenza. Se puede considerar el uso de peramivir intravenoso en pacientes hospitalizados que no toleran o no absorben el oseltamivir por vía oral o enteral por estasis gástrica posible o confirmada, absorción incorrecta o sangrado gastrointestinal (Lee, 2017; de Jong, 2014; Ison, 2014; Ison, 2013). No hay datos suficientes que respalden el uso general del zanamivir para inhalar y el peramivir intravenoso en pacientes con influenza grave. No hay datos disponibles de ensayos clínicos sobre el uso del baloxavir en pacientes con un cuadro grave de influenza que no están hospitalizados.
**El oseltamivir oral y baloxavir oral son opciones disponibles para tratar a pacientes con mayor riesgo de tener complicaciones graves por la influenza, según la edad y las afecciones subyacentes (Tabla 1). Los datos sobre el uso de peramivir o zanamivir son muy limitados en pacientes ambulatorios de alto riesgo con influenza.
- Se prefiere el oseltamivir oral para el tratamiento de personas embarazadas (Rasmussen, 2011). Se recomienda que las personas embarazadas reciban la misma dosis de antivirales que las que no están embarazadas. Varios estudios han notificado que el uso de inhibidores de la neuraminidasa durante el embarazo es seguro. (Dunstan, 2014; Xie, 2013; Saito, 2013; Wollenhaupt, 2014; Beau, 2014; Svensson, 2011; Greer, 2010; Graner, 2017); Ehrenstien, 2018; Chambers, 2019; Bennekom, 2019; ACOG Committee, 2018). Ver Recomendaciones para los proveedores de atención médica en el área de obstetricia sobre el uso de medicamentos antivirales en el tratamiento y prevención de la influenza para obtener más información. No se recomienda el baloxavir para el tratamiento de la influenza en personas embarazadas o en período de lactancia ya que no hay datos disponibles sobre la eficacia o la seguridad del uso del baloxavir en esta población (Chow, 2021), y no hay datos disponibles sobre la presencia de baloxavir en la leche materna, los efectos en los lactantes o los efectos en la producción de leche.
- Los CDC no recomiendan el uso del baloxavir para una monoterapia de la influenza en personas gravemente inmunodeprimidas. No hay datos disponibles sobre la eficacia, seguridad o resistencia de la monoterapia de influenza con baloxavir en pacientes gravemente inmunodeprimidos y la aparición de resistencia durante el tratamiento es una preocupación debido a una replicación prolongada del virus de la influenza en estos pacientes.
- Si es indicado, el tratamiento antiviral debe iniciarse cuanto antes después de la aparición de la enfermedad, lo ideal sería dentro de las 48 horas de la aparición de los síntomas para obtener el mayor beneficio clínico. Sin embargo, según estudios de observación, se ha notificado que el tratamiento de la influenza con antivirales también puede ser beneficioso para los pacientes que tienen enfermedades progresivas, complicadas o graves o que han sido hospitalizados si se administra después de 48 horas del inicio de la enfermedad.
- No se debería esperar la confirmación de la influenza del laboratorio para tomar las decisiones sobre el comienzo del tratamiento antiviral (ver los recursos adicionales sobre Descripción clínica y diagnóstico de laboratorio de la influenza para obtener más información sobre las pruebas del diagnóstico de influenza).
- El beneficio clínico es mayor cuando el tratamiento antiviral se inicia tan cerca de la aparición de la enfermedad como sea posible.
- Según el criterio clínico del profesional, también se puede considerar el tratamiento antiviral con oseltamivir oral, zanamivir de inhalación, peramivir intravenoso o baloxavir oral para pacientes ambulatorios sintomáticos sanos con infección presunta o confirmada por el virus de la influenza que no corren mayor riesgo de presentar complicaciones graves, si el tratamiento se puede iniciar dentro de las 48 horas de la aparición de la enfermedad.
- El tratamiento recomendado para casos de influenza que no presentan complicaciones consiste en dos dosis por día de oseltamivir oral o zanamivir para inhalar durante 5 días o una dosis de peramivir por vía intravenosa o baloxavir oral durante 1 día.
- Si bien la vacunación contra la influenza es la mejor manera de prevenir la influenza, un historial de vacunación contra la influenza no descarta la posibilidad de infección por el virus de la influenza en un paciente enfermo con signos clínicos y síntomas compatibles con la influenza.
Figura: guía para considerar la prueba para diagnosticar la influenza y el tratamiento cuando los virus están circulando en la comunidad (independientemente de su historial de vacunación contra la influenza)1
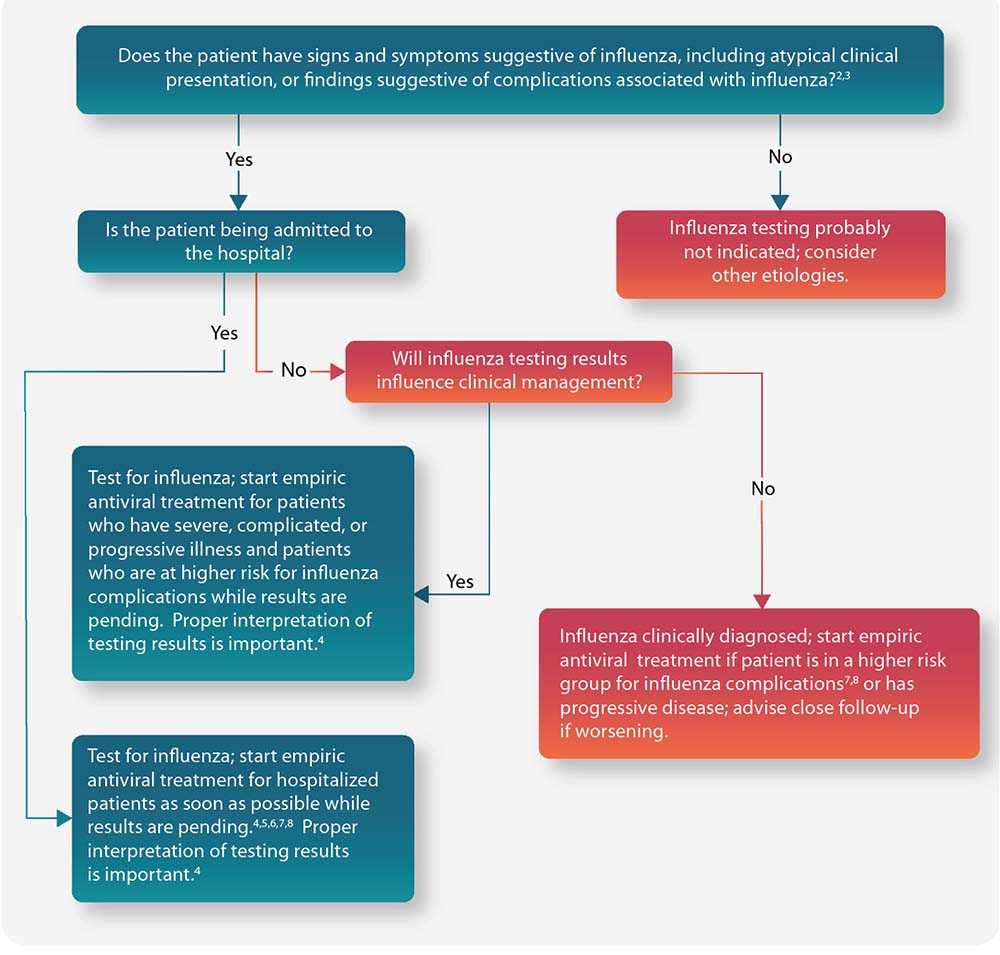
Están disponibles todas las notas a pie de página para este algoritmo.
- Adultos de 65 años de edad o más
- Niños menores de 2 años1
- Asma
- Afecciones neurológicas o del neurodesarrollo
- Trastornos sanguíneos (como anemia falciforme)
- Enfermedades pulmonares crónicas (como enfermedad pulmonar obstructiva crónica [COPD] y fibrosis quística)
- Trastornos endocrinos (como diabetes mellitus)
- Enfermedades cardiacas (como enfermedad cardiaca congénita, insuficiencia cardiaca congestiva y enfermedad de la arteria coronaria)
- Enfermedades del riñón
- Enfermedades del hígado
- Trastornos metabólicos (como trastornos metabólicos congénitos y trastornos mitocondriales)
- Personas que tienen obesidad, con un índice de masa corporal [IMC] de 40 o más
- Personas menores de 19 años de edad que toman medicamentos a largo plazo que contienen aspirina o salicilato
- Personas con sistema inmunitario debilitado debido a una enfermedad (como personas con VIH o SIDA o cáncer como la leucemia) o medicamentos (como los que reciben tratamientos radiológicos o de quimioterapia para tratar el cáncer o personas con afecciones crónicas que requieren corticosteroides u otros medicamentos que comprometen el sistema inmunitario)
- Personas que hayan tenido un accidente cerebrovascular
- Personas embarazadas y personas que dieron a luz hace menos de 2 semanas
- Personas que viven en asilos de ancianos y otros establecimientos de cuidados a largo plazo
- Las personas de ciertos grupos de minorías raciales y étnicas tienen mayor riesgo de ser hospitalizadas a causa de la influenza, entre ellas las personas de color no hispanas, las personas hispanas o latinas, y las personas de comunidades indígenas estadounidenses y nativas de Alaska. Debería considerarse el tratamiento antiviral temprano para la influenza a pacientes ambulatorios en estos grupos de minorías raciales y étnicas.
1A pesar de que todos los niños menores de 5 años corren mayor riesgo de tener complicaciones graves por la influenza, el riesgo es aún mayor en menores de 2 años, con los índices más altos de hospitalizaciones y muertes entre bebés menores de 6 meses. Debido a que muchos niños con enfermedad respiratoria febril leve pueden padecer otras infecciones virales (p. ej., SARS-CoV-2, virus respiratorio sincitial, rinovirus, virus respiratorio parainfluenza o metapneumovirus humano), es importante conocer sobre otros virus respiratorios y cepas de virus de la influenza que circulan en la comunidad para orientar las decisiones de tratamiento.
Las siguientes recomendaciones no necesariamente reflejan los usos aprobados por la FDA de productos antivirales, pero se basan en estudios de observación publicados y opiniones de expertos, y están sujetas a modificaciones a medida que avanzan los productos en investigación y las características epidemiológicas y virológicas de la influenza a lo largo del tiempo.
- Para pacientes hospitalizados con influenza presunta o confirmada, se recomienda la iniciación del tratamiento antiviral con oseltamivir administrado por vía oral o enteral lo antes posible. El tratamiento antiviral puede ser eficaz para reducir la morbilidad y mortalidad en pacientes hospitalizados con influenza, especialmente en adultos, incluso si el tratamiento se inicia más de 48 horas después de la aparición de la enfermedad.
- El zanamivir de inhalación, el baloxavir oral y el peramivir intravenoso no se recomiendan para pacientes hospitalizados con influenza presunta o confirmada debido a la falta de datos que demuestren un beneficio clínico de estos antivirales en pacientes hospitalizados a causa de la influenza. Además, los datos para el tratamiento con peramivir intravenoso en pacientes hospitalizados con influenza no son suficientes.
- Se desconoce cuál es la duración óptima y la dosificación del tratamiento antiviral en casos complicados o de influenza grave. Puede que haya que alterar los regímenes de tratamiento para adaptarlos a las circunstancias clínicas.
- Las decisiones acerca de extender (prolongar) la duración del tratamiento en paciente cuya enfermedad persiste la debería tomar un profesional médico.
- Los exámenes virales de muestras de las vías respiratorias inferiores realizados mediante la reacción en cadena de la polimerasa con transcriptasa inversa en tiempo real (RT-PCR) pueden ayudar a guiar las decisiones acerca de prolongar el tratamiento en pacientes hospitalizados con influenza grave o persistente. Los pacientes en estado crítico con insuficiencia respiratoria pueden experimentar una replicación prolongada del virus de la influenza en las vías respiratorias inferiores y pueden beneficiarse con un tratamiento de mayor duración.
- Regímenes de tratamiento más prolongados podrían ser necesarios en pacientes inmunodeprimidos que podrían experimentar una replicación viral de la influenza. Dichos pacientes corren riesgo de aparición de virus de influenza con susceptibilidad reducida o resistencia antiviral durante el tratamiento antiviral y posteriormente.
- Algunos expertos han recomendado una dosis más alta de oseltamivir administrado por vía oral o por vía enteral (p. ej., 150 mg dos veces al día en adultos con función renal normal) para el tratamiento de la influenza en pacientes inmunodeprimidos y en pacientes hospitalizados en estado grave. No obstante, se ha notificado que el oseltamivir administrado por vía oral o por vía enteral es absorbido adecuadamente en adultos gravemente enfermos, y que la dosis estándar produce niveles terapéuticos en sangre (Ariano, 2010), y los datos limitados indican que dosis más altas quizás no produzcan más beneficios clínicos (Abdel-Ghafar, 2008; Ariano, 2010; Kumar, 2010; Lee, 2013; Red de Investigación Clínica de Enfermedades Infecciosas del Sureste de Asia, 2013).
- Estudios indican que la exposición al carboxilato de oseltamivir (el metabolito activo del oseltamivir) es similar entre personas obesas y no obesas para quienes se recomiendan dosis de 75 mg y 150 mg, dos veces al día (Ariano, 2010; Jittamala, 2014; Pai, 2011; Thorne-Humphrey, 2011).
- Existe información limitada que sugiere que el oseltamivir administrado por vía oral o por sonda orogástrica/nasogástrica es bien absorbido en pacientes con influenza grave, incluidos aquellos pacientes que reciben terapia de reemplazo renal continua y/o con oxigenación por membrana extracorporal (Ariano, 2010; Eyler, 2012a; Eyler, 2012b; Giraud, 2011; Kromdijk, 2013; Lemaitre, 2012; Mulla, 2013; Taylor, 2008).
- Si un paciente hospitalizado bajo tratamiento con oseltamivir o peramivir manifiesta síntomas de infecciones en las vías respiratorias inferiores, debería considerarse la posibilidad de un virus resistente. Sin embargo, los médicos deben tener en cuenta que lo más probable es que la falta de mejoría o el deterioro clínico durante el tratamiento con oseltamivir o peramivir esté asociado más bien a los antecedentes naturales de daño pulmonar grave y lesiones inflamatorias o al inicio de otras complicaciones (por ej., falla renal, choque séptico, neumonía asociada a la ventilación) que a la aparición de la resistencia al oseltamivir o peramivir.
- También es crucial prestar especial atención al manejo de respiradores y líquidos y a la prevención y tratamiento de la neumonía bacteriana secundaria (p. ej., S. pneumoniae, S. pyogenes y S. aureus, incluido MRSA) en caso de pacientes con enfermedad grave (Bautista, 2010; Finelli, 2008; Hageman, 2006; Harper, 2009; Mandell, 2007; Mauad, 2010; Shieh, 2010).
Agente antiviral
Agente antiviral
Use
Uso
Niños
Niños
Adultos
Adultos
Oseltamivir oral
Oseltamivir oral
Tratamiento (5 días)1
Tratamiento (5 días)1
Si es menor de 1 año2: 3 mg/kg/dosis dos veces por día3,4 Si tiene 1 año o más, la dosis varía según el peso del niño: 15 kg o menos, la dosis es de 30 mg dos veces por día; >15 a 23 kg, la dosis es de 45 mg dos veces por día; >23 a 40 kg, la dosis es de 60 mg dos veces por día; >40 kg, la dosis es de 75 mg dos veces por día
Si es menor de 1 año2: 3 mg/kg/dosis dos veces por día3,4 Si tiene 1 año o más, la dosis varía según el peso del niño: 15 kg o menos, la dosis es de 30 mg dos veces por día; >15 a 23 kg, la dosis es de 45 mg dos veces por día; >23 a 40 kg, la dosis es de 60 mg dos veces por día; >40 kg, la dosis es de 75 mg dos veces por día
75 mg dos veces por día
75 mg dos veces por día
Quimioprofilaxis (7 días)5
Quimioprofilaxis (7 días)5
Si el niño tiene menos de 3 meses, no se recomienda el uso de oseltamivir para la quimioprofilaxis a menos que se considere que la situación es crítica debido a los datos limitados que existen para este grupo etario. Si el niño tiene 3 meses o más y menos de 1 año2: 3 mg/ kg/dosis una vez por día3 Si tiene 1 año de edad o más, la dosis varía según el peso: 15 kg o menos, la dosis es de 30 mg una vez por día; >15 a 23 kg, la dosis es 45 mg una vez por día; >23 a 40 kg, la dosis es 60 mg una vez por día; >40 kg, la dosis es de 75 mg una vez por día
Si el niño tiene menos de 3 meses, no se recomienda el uso de oseltamivir para la quimioprofilaxis a menos que se considere que la situación es crítica debido a los datos limitados que existen para este grupo etario. Si el niño tiene 3 meses o más y menos de 1 año2: 3 mg/ kg/dosis una vez por día3 Si tiene 1 año de edad o más, la dosis varía según el peso: 15 kg o menos, la dosis es de 30 mg una vez por día; >15 a 23 kg, la dosis es 45 mg una vez por día; >23 a 40 kg, la dosis es 60 mg una vez por día; >40 kg, la dosis es de 75 mg una vez por día
75 mg una vez por día
75 mg una vez por día
Zanamivir para inhalar6
Zanamivir para inhalar6
Tratamiento (5 días)
Tratamiento (5 días)
10 mg (dos inhalaciones de 5 mg) dos veces al día
(Aprobado y recomendado por la FDA para usar en niños de 7 años de edad o más)
10 mg (dos inhalaciones de 5 mg) dos veces al día
(Aprobado y recomendado por la FDA para usar en niños de 7 años de edad o más)
10 mg (dos inhalaciones de 5 mg) dos veces al día
10 mg (dos inhalaciones de 5 mg) dos veces al día
Quimioprofilaxis (7 días)5
Quimioprofilaxis (7 días)5
10 mg (dos inhalaciones de 5 mg) una vez al día
(Aprobado y recomendado por la FDA para usar en niños de 5 años de edad o más)
10 mg (dos inhalaciones de 5 mg) una vez al día
(Aprobado y recomendado por la FDA para usar en niños de 5 años de edad o más)
10 mg (dos inhalaciones de 5 mg) una vez al día
10 mg (dos inhalaciones de 5 mg) una vez al día
Peramivir intravenoso7
Peramivir intravenoso7
Tratamiento (1 día)1
Tratamiento (1 día)1
(6 meses a 12 años de edad) Una dosis de 12 mg/kg, hasta un máximo de 600 mg, por infusión intravenosa durante un mínimo de 15 minutos
(Aprobado y recomendado por la FDA para usar en niños de 6 meses o más)
(6 meses a 12 años de edad) Una dosis de 12 mg/kg, hasta un máximo de 600 mg, por infusión intravenosa durante un mínimo de 15 minutos
(Aprobado y recomendado por la FDA para usar en niños de 6 meses o más)
(13 años en adelante) Una dosis de 600 mg por infusión intravenosa durante un mínimo de 15 minutos
(13 años en adelante) Una dosis de 600 mg por infusión intravenosa durante un mínimo de 15 minutos
Quimioprofilaxis8
Quimioprofilaxis8
No se recomienda
No se recomienda
No se aplica
No se aplica
Baloxavir oral9
Baloxavir oral9
Tratamiento (1 día)
Tratamiento (1 día)
(5 años de edad o más con un peso <20 kg: dosis única de 2 mg/kg, con un peso de entre 20 y <80 kg: dosis única de 40 mg en tableta o suspensión; con un peso ≥80: dosis única de 80 mg en tableta o suspensión)
Aprobado por la FDA y recomendado para usar en niños sanos de 5 años de edad o más.
(5 años de edad o más con un peso <20 kg: dosis única de 2 mg/kg, con un peso de entre 20 y <80 kg: dosis única de 40 mg en tableta o suspensión; con un peso ≥80: dosis única de 80 mg en tableta o suspensión)
Aprobado por la FDA y recomendado para usar en niños sanos de 5 años de edad o más.
Peso <80 kg: una dosis de 40 mg;
Peso ≥80 kg: una dosis de 80 mg9
Peso <80 kg: una dosis de 40 mg;
Peso ≥80 kg: una dosis de 80 mg9
Quimioprofilaxis9
Quimioprofilaxis9
Aprobado por la FDA como profilaxis posterior a la exposición para personas de 5 años de edad o más. La dosis es la misma que para el tratamiento.
Aprobado por la FDA como profilaxis posterior a la exposición para personas de 5 años de edad o más. La dosis es la misma que para el tratamiento.
La dosis es la misma que para el tratamiento
La dosis es la misma que para el tratamiento
Abreviaturas: N/A: no aprobado
- Un tratamiento más prolongado podría ser necesario en el caso de pacientes gravemente enfermos.
- El oseltamivir oral está aprobado por la FDA para el tratamiento de la influenza aguda pero sin complicaciones dentro de los 2 días de la aparición de la enfermedad con una dosis dos veces por día en personas de 14 días de vida o más y para la quimioprofilaxis con una dosis diaria en personas de 1 año de edad o más. Si bien el uso de oseltamivir oral para el tratamiento de la influenza en bebés con menos de 14 días de vida y para la quimioprofilaxis en bebés de 3 meses a 1 años no forma parte de las indicaciones aprobadas por la FDA, los CDC y la Academia Estadounidense de Pediatría (American Academy of Pediatrics) lo recomiendan (Recommendations for Prevention and Control of Influenza in Children, 2023–2024).
- Esta es la dosis aprobada por la FDA para el tratamiento con oseltamivir en bebés de más de 14 días de vida y menores de 1 año, y estipula una exposición al oseltamivir en niños similar a la observada con la dosis aprobada de 75 mg por vía oral, dos veces al día, en adultos, como se muestra en dos estudios sobre la farmacocinética del oseltamivir realizados en niños (Kimberlin, 2013 [3.44 MB, 74 páginas] [CASG 114], Estudio WP22849 de la UE, revisión de farmacología clínica de la FDA [3.44 MB, 74 páginas]). La American Academy of Pediatrics ha recomendado una dosis de tratamiento con oseltamivir de 3.5 mg/kg por vía oral, dos veces al día, para bebés de 9 a 11 meses, según los datos que indican que era necesario usar una dosis más alta de 3.5 mg/kg para lograr la exposición objetivo definida en el protocolo para este grupo, según se define en el estudio CASG 114 (Kimberlin, 2013 [3.44 MB, 74 páginas]). No se sabe si esta dosis más alta mejorará la eficacia o si evitará el desarrollo de la resistencia antiviral. Sin embargo, no hay pruebas que demuestren que la dosis de 3.5 mg/kg sea nociva o que cause más eventos adversos en los bebés, en este grupo etario.
- Las recomendaciones actuales de dosificación según el peso no son apropiadas para los bebés prematuros. Los bebés prematuros pueden tener una depuración más lenta del oseltamivir oral por la función renal inmadura. Las dosis recomendadas para los bebés nacidos a término pueden ocasionar una concentración muy alta de medicamento en este grupo etario. Tanto los CDC como la Academia Estadounidense de Pediatría recomiendan las siguientes dosis (Recommendations for Prevention and Control of Influenza in Children, 2023–2024): los datos limitados publicados por el Grupo Colaborativo de Vigilancia Epidemiológica del Instituto Nacional de Alergias y Enfermedades Infecciosas brindan la base de las dosis para bebés prematuros usando su edad postmenstrual (edad gestacional + edad cronológica): una dosis de 1 mg/kg, por vía oral, dos veces al día, para aquellos niños de <;38 semanas de edad postmenstrual; una dosis de 1.5 mg/kg, por vía oral, dos veces al día, para aquellos niños de 38 a 40 semanas de edad postmenstrual; una dosis de 3 mg/kg, por vía oral, dos veces al día, para aquellos niños de >;40 semanas de edad postmenstrual.
- Vea la siguiente sección de las Consideraciones especiales para entornos institucionales para obtener datos relacionados con la duración de la quimioprofilaxis para brotes en entornos institucionales.
- El zanamivir para inhalación está aprobado para el tratamiento de la influenza aguda sin complicaciones dentro de los 2 días de la aparición de la enfermedad con una dosis dos veces por día en personas de ≥7 años de edad y para la quimioprofilaxis con una dosis una vez por día en personas de ≥5 años de edad.
- El peramivir intravenoso está aprobado para el tratamiento de la influenza aguda sin complicaciones dentro de los 2 días de la aparición de la enfermedad con una sola dosis en personas de ≥6 meses de edad. Se utilizó una dosis diaria durante 5 días como mínimo en ensayos clínicos de pacientes hospitalizados con influenza (de Jong, 2014, Ison, 2014).
- No hay datos sobre el uso de peramivir para la quimoprofilaxis de la influenza.
- El baloxavir marboxil oral está aprobado por la FDA para el tratamiento de la influenza aguda pero sin complicaciones dentro de los 2 días de la aparición de la enfermedad en personas de ≥5 años de edad que están sanas o en personas de ≥12 años de edad que tienen alto riesgo de presentar complicaciones relacionadas con la influenza. Baloxavir marboxil (Xofluza) [prospecto] [445 KB, 16 páginas]. El baloxavir marboxil no se debe administrar con productos lácteos, bebidas fortificadas con calcio, laxantes de cationes polivalentes, antiácidos ni suplementos orales (como calcio, hierro, magnesio, selenio o zinc); la administración junto con productos que contienen cationes polivalentes puede reducir las concentraciones en plasma de baloxavir y reducir su eficacia. No hay datos publicados disponibles de ensayos clínicos sobre el tratamiento de la influenza con baloxavir en pacientes no hospitalizadas que están embarazadas, pacientes inmunodeprimidos o gravemente enfermos.
Un ensayo clínico aleatorizado notificó que la combinación de un inhibidor de la neuraminidasa (principalmente oseltamivir) y baloxavir para el tratamiento de pacientes hospitalizados con influenza de ≥12 años de edad no arrojó un beneficio clínico superior (periodo de mejora clínica) en comparación con el inhibidor de la neuraminidasa y el placebo (Kumar, 2022).
El baloxavir está aprobado por la FDA para la profilaxis posterior a la exposición de la influenza en personas de ≥5 años de edad, dentro de las 48 horas del contacto con una persona con influenza.
- La resistencia antiviral y la susceptibilidad reducida a los inhibidores de la neuraminidasa y al baloxavir entre los virus de la influenza en circulación actualmente es baja, pero esto puede cambiar.
- Para obtener datos de vigilancia semanal sobre la susceptibilidad de los virus en circulación a los antivirales en los EE. UU. esta temporada, consulte el Informe semanal sobre vigilancia de la influenza FluView de los EE.UU.
- Los virus de la influenza con resistencia antiviral o susceptibilidad reducida pueden ocurrir esporádicamente (Hurt, 2011; Takashita, 2013; Takashita, 2014) o surgir durante o después del tratamiento antiviral en ciertos pacientes (p. ej., con sistema inmunitario deprimido).
- Puede haber resistencia al oseltamivir en casos de virus de la influenza A(H3N2) y A(H1N1)pdm09 durante el tratamiento, particularmente en niños pequeños (Roosenhoff, 2019; Lina, 2018;) y personas inmunodeprimidas (Memoli, 2014).
- Es posible que algunos virus de influenza puedan volverse menos sensibles o resistentes al oseltamivir y al peramivir durante el tratamiento antiviral con uno de estos medicamentos y sigan siendo sensibles al zanamivir; esto se ha notificado con mayor frecuencia para los virus de influenza A(H1N1)pdm09 (Graitcer, 2011; Lackenby, 2011; Memoli, 2010; Nguyen, 2010; Nguyen, 2012).
- También surgieron virus de influenza A(H1N1)pdm09 que son resistentes a todos los inhibidores de la neuraminidasa, incluido el zanamivir, en pacientes gravemente inmunodeprimidos con tratamiento prolongado con un inhibidor de la neuraminidasa (Tamura, 2015; L’Huillier, 2015).
- Se ha reportado una transmisión entre personas de los virus de influenza A(H1N1)pdm09 con una mutación H275Y en la neuraminidasa viral con resistencia al oseltamivir entre pacientes con el sistema inmunitario gravemente deprimido en hospitales, (Gooskens, 2009; Chen, 2011;) y en la comunidad (Hibino, 2017; Le, 2008; Hurt, 2011; Hurt, 2012; Takashita, 2013), pero actualmente al parecer es algo inusual.
- Después del tratamiento con baloxavir, se ha observado en ensayos clínicos la aparición de virus con marcadores moleculares asociados a una susceptibilidad reducida al baloxavir en niños y adultos inmunocompetentes con una mayor detección entre los pacientes pediátricos tratados con baloxavir de <12 años en comparación con los pacientes adultos (Hayden, 2018; Omoto, 2018; Hirostu, 2019; Uehara, 2019; Takashita, 2019).
- Se ha reportado una transmisión esporádica entre personas del virus de influenza A(H3N2) con susceptibilidad reducida al baloxavir entre niños japoneses (Takashita, 2019; Takashita 2019; Imai, 2019), pero actualmente al parecer es algo inusual.
- Los análisis moleculares pueden detectar cambios genéticos en los virus de la influenza asociados a la resistencia y susceptibilidad reducida al oseltamivir y al peramivir. Se puede consultar a la División de Influenza de los CDC sobre las pruebas de susceptibilidad antiviral cuando sea necesario. La información acerca de las pruebas de susceptabilidad al inhibidor de la neuraminidasa y la interpretación de los resultados de las pruebas de inhibición de la neuraminidasa están disponibles en el sitio web de la OMS.
Pacientes con influenza sin complicaciones
- Metaanálisis y ensayos clínicos controlados aleatorizados (RCT, por sus siglas en inglés) han demostrado la eficacia de la iniciación temprana del tratamiento (se inició dentro de las 36 a 48 horas de la aparición de la enfermedad) con inhibidores de la neuraminidasa para reducir la duración de la fiebre y los síntomas de la enfermedad en comparación con el placebo en adultos y niños sanos con influenza sin complicaciones ( Jefferson, 2014; Dobson, 2015; Malosh, 2018; Liu, 2021).
- Un ensayo clínico aleatorio en niños con influenza sin complicaciones demostró una leve disminución en la duración de los síntomas y en la propagación viral en pacientes que iniciaron el tratamiento después de las 48 horas; el análisis retrospectivo indicó que el tratamiento con oseltamivir iniciado 72 horas después de la aparición de la enfermedad redujo los síntomas en un día en comparación con el tratamiento con placebo (Fry, 2014).
- Un metaanálisis de RCT que compararon el tratamiento temprano con oseltamivir con el placebo o controles no activos entre adultos y adolescentes con influenza sin complicaciones no detectó ninguna reducción en el riesgo de hospitalización posterior por la influenza, pero no pudo detectar el efecto debido a la baja tasa de hospitalización entre las poblaciones de los ensayos (Hanula 2023; Antoon 2023; Uyeki 2023).
- Los RTC y metaanálisis de RTC que comparan el baloxavir con el placebo u oseltamivir entre niños y adultos con influenza sin complicaciones detectaron que el balozavir era superior al placebo y similar al oseltamivir al reducir la duración de los síntomas (Kuo, 2021; Portsmouth 2021).
- No hay datos disponibles sobre el uso del baloxavir para tratar la influenza después de que hayan pasado más de 2 días desde la aparición de la enfermedad en pacientes ambulatorios.
Pacientes hospitalizados
- No se realizaron ensayos clínicos aleatorizados, de administración controlada con placebo, de suficiente potencia y completados sobre la monoterapia con inhibidores de la neuraminidasa para el tratamiento de la influenza en pacientes hospitalizados; los estudios que respaldan la autorización del uso del oseltamivir oral, zanamivir de inhalación, peramivir intravenoso o baloxavir oral se realizaron en pacientes ambulatorios, principalmente entre personas con enfermedades sin complicaciones que anteriormente estaban sanas.
- Un análisis secundario de un ensayo clínico sin ocultación multicéntrico sobre el tratamiento con oseltamivir iniciado dentro de las 24 horas del ingreso al hospital frente al estándar de atención en adultos hospitalizados por una infección en las vías respiratorias inferiores notificó que el tratamiento con oseltamivir redujo el riesgo de fracaso clínico en los pacientes con influenza confirmada por laboratorio; el fracaso clínico fue definido como falta de mejoría en 7 días, traslado a la atención de la UCI 24 horas después del ingreso, o reingreso al hospital o muerte al cabo de 30 días (Wiemken, 2021).
- Varios estudios de observación en pacientes hospitalizados por influenza han demostrado el beneficio clínico del tratamiento antiviral con un inhibidor de la neuraminidasa en comparación con la falta de tratamiento, en particular cuando el tratamiento se inicia dentro de los dos días de la aparición de la enfermedad, o tan pronto como sea posible después del ingreso al hospital; dichos beneficios incluyen una menor duración de la hospitalización y menor riesgo de ser trasladados a la UCI, uso de ventilación mecánica invasiva o riesgo de muerte (Coffin, 2011; Hsu, 2012; Louie, 2013; Muthuri, 2013; Muthuri, 2014; Miyakawa, 2019; Lytras, 2019; Chen, 2020; Chen, 2020; Venkatesan, 2020; Katzen, 2019; Reacher, 2019; Walsh, 2022).
- Algunos estudios de observación han notificado que el tratamiento con oseltamivir oral que se inició 4 y 5 días después de la aparición de la enfermedad en pacientes hospitalizados con infección presunta o confirmada por influenza estuvo asociado a un menor riesgo de muerte (EH Lee, 2010; N Lee, 2008; N Lee, 2010; Louie, 2012; McGeer, 2007), aunque un informe reveló este beneficio solo en pacientes adultos hospitalizados en la UCI (Muthuri, 2014). Una pequeña cantidad de estudios de observación y un metaanálisis de estudios de observación de pacientes hospitalizados con influenza notificaron que el tratamiento con inhibidor de la neuraminidasa no estuvo asociado a una reducción en el riesgo de muerte (Choi, 2017; Wolkewitz, 2016; Heneghan, 2016).
- Un ensayo clínico aleatorizado notificó que la combinación de un inhibidor de la neuraminidasa (principalmente oseltamivir) y el baloxavir para el tratamiento de pacientes hospitalizados con influenza de ≥12 años de edad no arrojó un beneficio clínico superior (periodo de mejora clínica) en comparación con el tratamiento con inhibidor de la neuraminidasa y placebo, lo que indica que incorporación del baloxavir no produjo un beneficio clínico adicional, pero redujo significativamente los niveles de ARN viral de la influenza en muestra nasofaríngea (Kumar, 2022).
- Los estudios de observación realizados en pacientes hospitalizados con influenza han demostrado que el beneficio clínico es mayor cuando el tratamiento con oseltamivir comienza dentro de las 48 horas del inicio de la enfermedad (Hsu, 2012; Louie, 2013; Muthuri, 2013; Muthuri, 2014). Sin embargo, algunos estudios indican que el tratamiento antiviral aún puede ser beneficioso en pacientes hospitalizados si se inicia entre los 4 y 5 días posteriores al comienzo de la enfermedad (Louie, 2012; Yu, 2011).
-
- Se ha demostrado que el tratamiento con antivirales en cualquier trimestre en personas embarazadas con infección por el virus de la influenza A(H1N1)pdm09 es el más beneficioso para la prevención de insuficiencia respiratoria y muerte cuando se comenzó dentro de menos de 2 días de la aparición de la enfermedad (Siston, 2010).
- Los estudios de observación realizados en pacientes hospitalizados con influenza han demostrado que el beneficio clínico es mayor cuando el tratamiento con oseltamivir u otro inhibidor de la neuraminidasa se inicia al ingresar al hospital o inmediatamente después de ser hospitalizado que cuando se demora el inicio del tratamiento antiviral o directamente no se realiza dicho tratamiento (Katzen, 2018, Venkatesan, 2019).
- Los estudios de observación en pacientes adultos hospitalizados con influenza han notificado que el inicio del tratamiento con oseltamivir dentro de las 48 horas posteriores al ingreso puede reducir los ingresos a la UCI, los reingresos al hospital en 30 días y los casos de mortalidad en comparación con la iniciación posterior del tratamiento o la falta de tratamiento (Sharma 2021, Groeneveld 2020).
- Tratamiento: la duración recomendada para el tratamiento antiviral de la influenza sin complicaciones en pacientes ambulatorios es de 5 días para el oseltamivir oral o zanamivir de inhalación. Para el tratamiento de la influenza sin complicaciones con peramivir intravenoso o baloxavir oral, se recomienda una sola dosis. Se puede considerar una dosis diaria para tratamientos más prolongados (oseltamivir oral o peramivir intravenoso) para pacientes hospitalizados con influenza que continúan gravemente enfermos luego de 5 días de tratamiento. Para obtener un mayor beneficio clínico, el tratamiento debería iniciarse cuanto antes luego de que aparezcan los síntomas.
- Quimioprofilaxis: la duración recomendada es de 7 días (luego de la última exposición conocida). Para controlar los brotes en los entornos institucionales (p. ej., establecimientos de cuidados a largo plazo para adultos mayores y niños) y en los hospitales, los CDC recomiendan la quimioprofilaxis antiviral de residentes expuestos con oseltamivir oral o zanamivir de inhalación durante 2 semanas como mínimo, y continuarla por hasta 1 semana luego de la identificación del último caso conocido. Se recomienda la quimioprofilaxis antiviral a todos los residentes, incluidos aquellos que se han vacunado contra la influenza. Para el control de algunos brotes institucionales de influenza, se ha utilizado el tratamiento antiviral posterior a la exposición (p. ej., oseltamivir dos veces al día durante 5 días) en lugar de la quimioprofilaxis antiviral posterior a la exposición (Uyeki, 2019). El baloxavir está aprobado como profilaxis posterior a la exposición (dosis única) para la influenza en personas de 5 años de edad o más dentro de las 48 horas de contacto con una persona con influenza.
El ajuste de la dosis de oseltamivir se recomienda en pacientes cuya depuración de creatinina se encuentra entre los 10 y 60 mL/min y en pacientes con enfermedad renal en etapa terminal (ESRD) que están recibiendo hemodiálisis o diálisis peritoneal continua que reciben oseltamivir para el tratamiento o la quimioprofilaxis de la influenza. No se recomienda el uso de oseltamivir en pacientes con ESRD que no están recibiendo diálisis. Las dosis recomendadas se detallan en la Tabla 3; la duración del tratamiento y la quimioprofilaxis es la misma que la que se recomienda para pacientes con función renal normal. La dosis de peramivir intravenoso debería disminuirse en pacientes cuya depuración de creatinina de referencia está por debajo de los 50 mL/min (ver Tabla 3).
No se recomienda ajustar la dosis del zanamivir para inhalar en el tratamiento de 5 días de pacientes con insuficiencia renal. El análisis de farmacocinética no identificó un efecto clínicamente significativo de la función renal sobre la farmacocinética del baloxavir en pacientes con depuración de creatinina de 50 mL/min. y más. No se evaluaron los efectos de una insuficiencia renal grave sobre la farmacocinética de baloxavir marboxil o su metabolito activo, baloxavir.
Tabla 3. Ajuste de la dosis de oseltamivir y peramivir recomendada para el tratamiento o la quimioprofilaxis de la influenza en pacientes adultos con insuficiencia renal o enfermedad renal en etapa terminal (ESRD) y que están recibiendo diálisis*
Depuración de creatinina
Depuración de creatinina
Régimen de tratamiento recomendado
Régimen de tratamiento recomendado
Régimen de quimioprofilaxis recomendado
Régimen de quimioprofilaxis recomendado
Oseltamivir oral1
Oseltamivir oral1
Depuración de creatinina de 61 a 90 mL/min
Depuración de creatinina de 61 a 90 mL/min
75 mg dos veces al día
75 mg dos veces al día
75 mg una vez por día
75 mg una vez por día
Depuración de creatinina de 31 a 60 mL/min
Depuración de creatinina de 31 a 60 mL/min
30 mg dos veces al día
30 mg dos veces al día
30 mg una vez por día
30 mg una vez por día
Depuración de creatinina de 11 a 30 mL/min
Depuración de creatinina de 11 a 30 mL/min
30 mg una vez por día
30 mg una vez por día
30 mg día de por medio
30 mg día de por medio
Depuración de creatinina en pacientes con ESRD que están recibiendo hemodiálisis ≤10 mL/min.
Depuración de creatinina en pacientes con ESRD que están recibiendo hemodiálisis ≤10 mL/min.
30 mg después de cada ciclo de hemodiálisis. La duración del tratamiento no debe superar los 5 días2
30 mg después de cada ciclo de hemodiálisis. La duración del tratamiento no debe superar los 5 días2
30 mg después de ciclos alternos de hemodiálisis3
30 mg después de ciclos alternos de hemodiálisis3
Pacientes con ESRD que están recibiendo diálisis peritoneal continua ambulatoria4 Depuración de creatinina de ≤ de 10 mL/min.
Pacientes con ESRD que están recibiendo diálisis peritoneal continua ambulatoria4 Depuración de creatinina de ≤ de 10 mL/min.
Una dosis única de 30 mg administrada inmediatamente después del intercambio de diálisis
Una dosis única de 30 mg administrada inmediatamente después del intercambio de diálisis
30 mg una vez a la semana después del intercambio de diálisis
30 mg una vez a la semana después del intercambio de diálisis
Peramivir intravenoso (única dosis)5
Peramivir intravenoso (única dosis)5
Depuración de creatinina ≥ de 50 mL/min.
Depuración de creatinina ≥ de 50 mL/min.
600 mg
600 mg
No se aplica
No se aplica
Depuración de creatinina de 30 a 49 mL/min
Depuración de creatinina de 30 a 49 mL/min
200 mg
200 mg
No se aplica
No se aplica
Depuración de creatinina de 10 a 29 mL/min
Depuración de creatinina de 10 a 29 mL/min
100 mg
100 mg
No se aplica
No se aplica
Pacientes con ESRD que están recibiendo hemodiálisis
Pacientes con ESRD que están recibiendo hemodiálisis
Dosis administrada posterior a la sesión de diálisis a una dosis ajustada según la depuración de creatinina
Dosis administrada posterior a la sesión de diálisis a una dosis ajustada según la depuración de creatinina
* Para conocer el resumen de las características del producto para oseltamivir y peramivir; consulte FDA: Medicamentos antivirales contra la influenza e información relacionada.
Abreviaturas: N/A = aprobado, no recomendado
- La dosis de oseltamivir en caso de deterioro de la función renal no está publicada en el prospecto para pacientes pediátricos. Sin embargo, estas tablas pueden utilizarse para los niños que pueden recibir las dosis de adultos teniendo en cuenta su peso (>;40 kg).
- Suponiendo que se realizan 3 sesiones de hemodiálisis en un periodo de 5 días. El tratamiento se puede iniciar inmediatamente si aparecen síntomas de influenza durante las 48 horas entre cada sesión de hemodiálisis; sin embargo, la dosis posterior a la hemodiálisis aún debería administrarse independientemente del momento en que se administró la primera dosis.
- Se puede administrar una primera dosis antes de comenzar con la diálisis.
- Los datos provienen de estudios realizados en pacientes que están recibiendo diálisis peritoneal continua ambulatoria (DPCA).
- La dosis de peramivir para pacientes con deterioro de la función renal en el prospecto está disponible para pacientes pediátricos: depuración de creatinina ≥50 mL/min.: 12 mg/kg (una dosis máxima de 600 mg); depuración de creatinina de 30 a 49 mL/min.: 4 mg/kg; depuración de creatinina de 10 a 29 mL/min.: 2 mg/kg.
- Al considerar el uso de medicamentos antivirales contra la influenza, los médicos deben considerar la edad del paciente, el peso y la función renal; la presencia de otras afecciones médicas; indicaciones de uso (es decir, quimioprofilaxis o terapia) y la posibilidad de interacción con otros medicamentos.
- Algunos RCT y metaanálisis de RCT han indicado que los síntomas gastrointestinales como náuseas y vómitos aumentan con el oseltamivir oral en comparación con el placebo; estas reacciones adversas pueden reducirse si se toma el oseltamivir con las comidas (Aoki, 2003; Malosh, 2018; Dobson, 2015, Liu, 2021). Un RCT del tratamiento empírico con oseltamivir en comparación con el placebo en niños de 0-9 años de edad hospitalizados con enfermedad respiratoria grave, incluidos >300 bebés de <1 año de edad, no detectó diferencias en las tasas de vómitos u otros síntomas gastrointestinales (Dawood, 2016).
- Para obtener más información sobre seguridad, efectividad y dosis de oseltamivir oral, zanamivir para inhalar, peramivir por vía intravenosa o baloxavir oral, visite Medicamentos antivirales o consulte el resumen de las características del producto.
- La coadministración del baloxavir con productos con cationes polivalentes puede reducir las concentraciones de plasma del baloxavir, lo cual podría reducir la eficacia. Evite la coadministración del baloxavir con laxantes con cationes polivalentes, antiácidos o suplementos por vía oral (p. ej., calcio, hierro, magnesio, selenio o zinc).
- La administración simultánea de los medicamentos antivirales con la vacuna contra la influenza con virus vivos atenuados (LAIV) puede inhibir la replicación viral de la LAIV y por consiguiente disminuir la eficacia de la vacunación con la LAIV. No se debe aplicar la LAIV si se administró oseltamivir o zanamivir en las 48 horas anteriores a la vacunación prevista, o si se administró peramivir dentro de los 5 días anteriores a la vacunación planificada, o si se administró baloxavir dentro de un período de 17 días anterior a la vacunación planificada. Si se aplica la LAIV y luego de administran medicamentos antivirales hasta dos semanas después de la vacunación, podría reducirse la efectividad de la LAIV, y las personas que reciben estos medicamentos dentro de las dos semana posteriores a la aplicación de la LAIV deben vacunarse nuevamente con otra vacuna para la influenza (como IIV o RIV4).
Para obtener más información, visite el sitio web de Influenza (gripe) estacional, envíe un correo electrónico a CDC-INFO, o llame a los CDC al 800-CDC-INFO (inglés y español) o 888-232-6348 (TTY).

Hay más información disponible para los médicos sobre las pruebas de diagnóstico de la influenza.

Los profesionales médicos deben contactar a su departamento de salud local o estatal para solicitar información acerca de la actividad local actual de la influenza. El informe FluView de los CDC ofrece información semanal sobre la actividad de la influenza a nivel nacional durante la temporada de influenza.
Descargo de responsabilidad: Es posible que en este sitio encuentre algunos enlaces que le lleven a contenido disponible sólo en inglés. Además, el contenido que se ha traducido del inglés se actualiza a menudo, lo cual puede causar la aparición temporal de algunas partes en ese idioma hasta que se termine de traducir (generalmente en 24 horas). Llame al 1-800-CDC-INFO si tiene preguntas sobre la influenza estacional, cuyas respuestas no ha encontrado en este sitio. Agradecemos su paciencia.

