Cómo se hacen las vacunas contra la influenza
En los Estados Unidos existen tres tecnologías diferentes de producción de vacunas contra la influenza aprobadas por la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA):
- vacuna contra la influenza a base de huevos,
- vacuna contra la influenza de cultivo celular, y
- vacuna recombinante contra la influenza.
Todas las vacunas contra la influenza comercialmente disponibles en los Estados Unidos están hechas por fabricantes del sector privado. Diferentes fabricantes utilizan tecnologías de producción diferentes, pero todas las vacunas contra la influenza cumplen con los requisitos de seguridad y efectividad de la FDA. Las diferentes vacunas tienen diferentes indicaciones. Vea Diferentes tipos de vacunas contra la influenza para obtener más información.
Vacunas a base de huevos contra la influenza
La forma más común de hacer vacunas contra la influenza es a través de un proceso de fabricación
a base de huevos que se ha utilizado durante más de 70 años. La fabricación de vacunas a base de huevos se utiliza para hacer tanto la vacuna inactivada (con virus muertos) (comúnmente llamada "vacuna inyectable contra la influenza") como la vacuna de virus vivos atenuados (a menudo denominada "vacuna contra la influenza en atomizador nasal").
El proceso de producción con huevo comienza cuando un laboratorio de los CDC o de alguno de los socios en el Sistema de Respuesta y Vigilancia Global de la Influenza de la OMS aporta a fabricantes del sector privado los virus de vacuna experimental (CVV, por sus siglas en inglés) cultivados en huevos según los requisitos regulatorios actuales de la FDA. Estos CVV luego son inyectados en huevos de gallina fertilizados y se los incuba por varios días para permitir la replicación de los virus. El líquido que contiene el virus se cosecha de los huevos. Para las vacunas inactivadas contra la influenza (p. ej., vacunas inyectables contra la influenza), los virus de la vacuna se inactivan (matan) y el antígeno del virus se purifica. El proceso de fabricación continúa con las pruebas de calidad, el empaque y la distribución. En el caso de la vacuna contra la influenza en atomizador nasal (es decir, la vacuna contra la influenza con virus vivos atenuados o LAIV), los CVV iniciales se usan para hacer virus vivos pero atenuados que luego se utilizan en la fabricación de las vacunas. La FDA prueba y autoriza todas las vacunas contra la influenza antes de su lanzamiento y envío.
Hay varios fabricantes diferentes que usan la tecnología de producción a base de huevos para fabricar las vacunas contra la influenza que se usan en los Estados Unidos. Este método de producción exige una gran cantidad de huevos de gallina para producir la vacuna y por lo general lleva más tiempo que otros métodos de producción utilizados.
Vacunas contra la influenza de cultivo celular
También existe un proceso de producción en cultivo celular para las vacunas contra la influenza que fue aprobado por la FDA en el 2012. Originalmente, este proceso de producción también se iniciaba con CVV cultivados en huevos de gallinas de conformidad con las reglamentaciones de la FDA. Sin embargo, el 31 de agosto del 2016, la FDA emitió una aprobación para Seqirus, el único fabricante de vacunas contra la influenza de cultivo celular aprobadas por la FDA, para comenzar a usar CVV reproducidos en cultivo celular. Actualmente, la fabricación en cultivo celular se usa para hacer vacunas inactivadas contra la influenza (p. ej., vacunas inyectables contra la influenza), no la LAIV (vacuna contra la influenza en atomizador nasal).
El proceso de crear vacunas contra la influenza en cultivo celular implica varios pasos. En primer lugar, los CDC o uno de sus laboratorios asociados usan los virus de la influenza que se han reproducido en células de mamíferos cultivadas para hacer los CVV, los cuales luego se entregan al fabricante de vacunas. Luego, el fabricante de vacunas inocula los CVV en las células de mamífero cultivadas (en lugar de hacerlo en huevos de gallina) y permite que los CVV se repliquen (es decir, hagan copias de sí mismos) por algunos días. Luego se recoge el líquido que contiene el virus de las células y se purifica el antígeno de los virus. El proceso de fabricación continúa con las etapas de purificación, inactivación de virus y prueba. Finalmente, la FDA prueba y aprueba las vacunas antes de su lanzamiento y envío.
La producción de vacunas contra la influenza en cultivo celular no requiere huevos de gallina porque los virus de la vacuna utilizados para hacer la vacuna se reproducen en cultivos de células de mamíferos (este proceso no daña de ningún modo a los animales). La tecnología a base de cultivo celular también tiene el potencial de agilizar el proceso de fabricación de la vacuna contra la influenza.
Aunque los virus utilizados en vacunas a base de cultivo celular de temporadas anteriores se desarrollaron en cultivos celulares, antes de la temporada 2019-2020, algunos de los virus proporcionados al fabricante primero habían sido propagados en huevos de gallina. Desde la temporada 2021-2022, los cuatro virus de la influenza utilizados en la vacuna a base de cultivo celular se desarrollan solo en cultivos celulares, lo que significa que la vacuna no contiene huevo.
Para obtener más información, vea la página web de los CDC sobre las Vacunas contra la influenza de cultivo celular.
Vacunas recombinantes contra la influenza
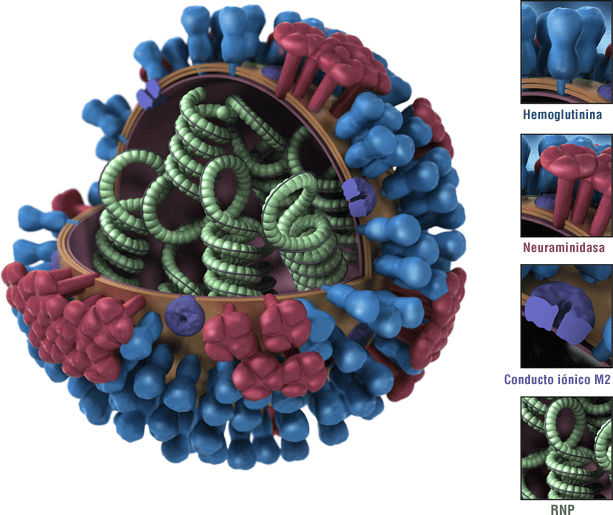
Esta es la imagen de un virus de la influenza. Las proteínas de superficie de la hemaglutinina (HA) del virus están representadas en azul. Las hemaglutininas de un virus de influenza son antígenos. Los antígenos son características del virus de la influenza que son reconocidas por el sistema inmunitario y pueden desencadenar una respuesta inmunitaria protectora. La mayoría de las vacunas contra la influenza están diseñadas para despertar una respuesta inmunitaria contra las HA de los virus de la influenza en circulación.
En el 2013 se aprobó una tercera tecnología de producción de vacunas contra la influenza para su uso en el mercado estadounidense, la cual implica el uso de tecnología recombinante. Las vacunas recombinantes contra la influenza no requieren el uso de virus de vacuna experimental (CVV) para su producción. En cambio, las vacunas recombinantes se fabrican través de la síntesis. Para hacer una vacuna recombinante, los científicos que estudian la influenza primero obtienen el gen de los virus que contiene las instrucciones genéticas para hacer la HA. La HA es un antígeno, que es una característica de un virus de la influenza que desencadena una respuesta del sistema inmunitario humano para crear anticuerpos que apuntan específicamente al virus. Este gen de la HA luego es combinado con un baculovirus, un virus que infecta a invertebrados. Esto da como resultado un baculovirus "recombinante". La función del baculovirus es ayudar a distribuir las instrucciones genéticas para convertir el antígeno HA de la influenza en una célula hospedadora. Una vez que el virus recombinante ingresa a la línea de células hospedadoras calificadas de la Administración de Alimentos y Medicamentos (FDA), le indica a las células que reproduzcan rápidamente el antígeno de la HA. Este antígeno es reproducido a granel, recolectado, purificado y posteriormente presentado como la vacuna recombinante contra la influenza. Antes de la aprobación de la FDA y del ofrecimiento de los lotes de vacunas al público, estas vacunas son probadas por la FDA para garantizar su calidad y potencia.
Este método de producción no requiere virus de la vacuna cultivados en huevos ni usa huevos de gallina en ninguna de las etapas del proceso de producción. Aunque existen otras vacunas que utilizan procesos de fabricación recombinantes similares, en este momento solo hay una vacuna contra la influenza aprobada por la FDA para su uso en los Estados Unidos. Este proceso de producción es el más rápido porque omite la necesidad de contar con CVV adaptados para el cultivo en huevos o de desarrollar virus de vacunas en cultivo celular.
Los CDC y la FDA monitorean la seguridad de todas las vacunas aprobadas en los Estados Unidos, incluidas las vacunas contra la influenza estacional. Hay más información disponible sobre la seguridad de las vacunas contra la influenza a base de huevos, de cultivo celular y recombinantes, incluidos eventos adversos, contraindicaciones y precauciones, exámenes médicos y administración segura de las vacunas en Seguridad de la vacuna contra la influenza estacional: resumen para médicos.
- La evolución y revolución de las vacunas contra la influenza en el sitio web de la Administración de Alimentos y Medicamentos de EE. UU.
- Investigación sobre vacunas contra la influenza en el sitio web del Instituto Nacional de Alergias y Enfermedades Infecciosas, NIH.
- Avances en la vacuna contra la influenza
Descargo de responsabilidad: Es posible que en este sitio encuentre algunos enlaces que le lleven a contenido disponible sólo en inglés. Además, el contenido que se ha traducido del inglés se actualiza a menudo, lo cual puede causar la aparición temporal de algunas partes en ese idioma hasta que se termine de traducir (generalmente en 24 horas). Llame al 1-800-CDC-INFO si tiene preguntas sobre la influenza estacional, cuyas respuestas no ha encontrado en este sitio. Agradecemos su paciencia.
